益气养血方对IL-1β诱导的大鼠软骨细胞增殖及β-catenin、WISP-1蛋白表达的影响
2019-10-18 国医在线 阅读
段荔 段姮妃 李兆福
(1. 云南中医药大学 2.云南中医学院第一附属医院)
[摘要] 目的:探讨益气养血方对体外培养的1L-1β诱导的骨关节炎模型软骨细胞增殖及β-catenin、WISP-1蛋白及MMP-1、MMP-13蛋白表达水平的影响,揭示其治疗骨关节炎部分机制。方法:建立大鼠膝关节软骨离体培养的软骨细胞模型,分为正常组和诱导组(含10 ng/mL IL-1β的10% FBS/DMEM进行干预),应用HE染色及免疫荧光检测进行形态学鉴定。将IL-1β诱导成功的软骨细胞随机分成8个组:益气养血方药物血清组(20%,10%,5%)、生理盐水血清组(20%,10%,5%)、阳性对照组(DKK-1 30ng/ml)和IL-1β(10 ng/ml )诱导组,并设置空白对照组,观察不同组间大鼠软骨细胞增殖情况;应用Western blot技术检测细胞β-catenin、WISP-1、MMP-1、MMP-13蛋白的表达。结果:益气养血方可促进1L-1β诱导的退变软骨细胞增殖,与空白对照组相比,IL-1β诱导软骨细胞分组β-catenin、WISP-1、MMP-1、MMP-13的蛋白表达水平水平均明显升高;20%益气养血方含药血清组β-catenin、WISP-1、MMP-1、MMP-13的蛋白表达低于阳性对照组。结论:益气养血方可能通过下调β-catenin、WISP-1调控Wnt/β-catenin信号通路,抑制下游MMP-1、MMP-13水平,可能是益气养血方减轻关节软骨破坏的机制之一。
[关键词] 益气养血方;体外培养;Wnt/β-catenin信号通路.
Effects of Yiqi Yangxue Decoction to protein level of β-catenin、WISP-1 in IL-1β induced Osteoarthritis chondrocyte model
Duan Li,Duan Hengfei,Wan Chunping,Xie Zhaohu, Lv Xiaoman,Li Zhaofu.
( 1 Yunnan Provincial Hospital of Traditional Chinese Medicine, Kunming 650021, China; 2 Yunnan University of Traditional Chinese Medicine, Kunming 650500, China )
[Abstract] Objective: To evaluate the effects of Yiqi Yangxue Decoction on chondrocyte proliferation and protein expression levels of β-catenin、WISP-1 MMP-1 and MMP-13 in chondrocytes of osteoarthritis model induced by 1l-1 β in vitro, to reveal part of its mechanism for treating osteoarthritis. Methods: The articular chondrocytes of SD rats were isolated and cultured,randomly divided into normal group and induction group. Morphological identified by the HE staining and immunofluorescence detection. The chondrocytes induced by IL-1 β were divided into 8 groups: Yiqi Yangxue Decoction serum group (20%、10%、5%), saline serum group (20%、10%、5%), positive control group (DKK-1 30ng/ml) and IL-1 β (10ng/ml) group, and set up blank control group. Observation of chondrocyte proliferation in different groups; detected the the protein levels of β-catenin、WISP-1、MMP-1、MMP-13 in cartilage tissues by immunohistochemical Western Blot. Results: Yiqi Yangxue Decoction can Promote the proliferation of chondrocytes. Compared with the control group, the expression of β-catenin,wisp-1,mmp-1,mmp-13 protein in chondrocytes induced by il-1 β was significantly increased, the protein expression of β-catenin,wisp-1,mmp-1,mmp-13 in 20% Yiqi Yangxue Decoction serum group was lower than that in the positive control group..Conclusion: Yiqi Yangxue Decoction may regulate Wnt/β-catenin signaling pathway by down-regulating the protein levels of β-catenin、WISP-1, inhibition the MMP-1,MMP-13 of downstream factors’ levels, may be one of the mechanisms of Yiqi Yangxue Decoction to alleviate the destruction of articular cartilage.
[Key words ] Yiqi Yangxue Decoction;cultured in vitro;Wnt/β-catenin signaling.
骨关节炎(Osteoarthritis,OA)是临床常见的慢性肌肉骨骼疾病和慢性致残性疾病,可累及骨、软骨下骨、滑膜、韧带、周围肌肉和关节囊 [[[] Neogi T.The epidemiology and impact of pain in osteoarthritis [J].Osteoarthritis Cartilage,2013,21( 9) : 1145-1153.]-2]。据统计原发性OA患病率在我国40岁以上的人群为46.3%,其中男性41.6%,女性50.4%,发病率随年龄增加,OA致残率可达53%[[[]葛均波, 徐永健. 内科学[M].北京:人民卫生出版社,2013:852.]]。在世界范围内,65岁以上人群80%有骨关节炎影像学变化,其中60%患者有明确症状[[[] GBD 2015 Disease and Injury Incidence and Prevalence Collaborators.Global, regional, and national incidence, prevalence, and years lived with disability for 310 diseases and injuries, 1990-2015: a systematic analysis for the Global Burden of Disease Study 2015 [J].The Lancet, vol. 388, no. 10053, pp. 1545–1602, 2016.]-5]。近年来随着研究的深入,骨关节炎不再仅仅是一个退行性的疾病,而是一个多因素共同作用的疾病,可导致一个或多个关节的废用[[[] Anwar Fathollahi, Saeed Aslani, Ahmadreza Jamshidi2. Epigeneticsinosteoarthritis:Novel spotlight[J]. Cell Physiol. 2019;1–16.]]。本研究采用1L-1β诱导的大鼠骨关节炎软骨细胞模型,进一步探讨益气养血方对β-catenin、WISP-1蛋白表达的的影响及对关节软骨退变模型中软骨细胞的作用,为益气养血方治疗骨关节炎提供理论依据。
1 材料
1.1实验动物 SPF级SD大鼠60只(雄性60只),4周龄,体重70~90g,购自辽宁长生生物技术股份有限公司(许可证号:SCXK〈辽〉2015-0001)。洁净饲养,供应的饲料和饮水均在消毒后由动物自由摄取。所有动物均严格按照国家和实验室动物使用管理条例进行实验设计和实验。
1.2药物
1.2.1 益气养血方的制备 益气养血方由黄芪、党参、陈皮等14味药组成(250g/剂),由我院中药房提供,将原药材混合,加水煎煮两次,第一次加4000 mL水熬煮40min,滤出。第二次加3000 mL水煎煮40min,滤出,将所得滤液混合,减压蒸馏浓缩至浸膏,称重,折合原药材为每1 g浸膏含生药量为2.53 g,经高温消毒后封瓶,4℃冰箱中保存备用。
1.2.2 试剂 Ⅱ型胶原酶(Solarbio),大鼠抗大鼠II型胶原单克隆抗体(Abcam),山羊抗大鼠多克隆二抗(FITC标记),SDS-PAGE电泳试剂(碧云天),DKK-1蛋白(北京索莱宝),IL-1β(北京索莱宝),FBS(Hyclone),DMEM高糖干粉(Gibco),CCK-8细胞增殖-毒性检测试剂盒
1.2.3仪器 细胞培养板(Corning,美国),低温台式离心机(UNIVERSAC16R,美国),倒置显微镜及成像系统(OLYMPUS的IX71及 CoolSNAP,日本),美国Bio-Tek连续波长酶标仪,Thermo Fisher Scientific细胞培养箱,Thermo Fisher Scientific生物安全柜,超低温冰箱,无菌器械,超净工作台[HFSafe 1200,CO.,Ltd.(香港)]等。
2 实验方法
2.1含药血清制备
SD大鼠20只,雄性,随机分为2组,每组10只,按血清药理学常规方法给药:3d(day)-2t(time)-1h(hour)模式。益气养血方含药血清组,以5倍临床等效剂量(18.90 g/kg/d)浸膏灌胃。生理盐水血清组予10 ml/kg/d生理盐水,每天分2次灌服,连续3天,给药期间照常进食,饮水。末次灌胃1h后,以腹腔注射水合氯醛30 mg/kg麻醉大鼠,在无菌条件下经腹主动脉采血,静置1 h后,离心机3000 rpm,10 min分离血清,取上清液,同组血清混合,灭活,除菌,分装,-20 ℃冰箱保存备用。
2.2 大鼠膝关节软骨原代细胞的制备及退变模型的诱导
2.2.1 大鼠关节软骨原代细胞的制备
4-6周大鼠脱颈处死,超净工作台中解剖,用手术刀片切取膝关节胫骨平台软骨,冲洗3次。将软骨组织剪碎至1 mm3左右大小。收集在50 ml离心管中。加入0.25%的胰蛋白酶5mL,消化 30 min。加入5 mL PBS清洗2次。再次加入0.25%的胰蛋白酶5mL,消化 30 min,倒掉胰酶消化液。加入0.2%的Ⅱ型胶原酶10 mL,置于37℃细胞培养箱中消化4-5 h,离心10 min,去消化液后加入细胞培养液震荡制成细胞悬液。过滤,之后将其加至10% FBS/DMEM中培养,24 h后观察细胞贴壁状态、细胞形态及生长状况,每3天更新一次培养基。观察原代细胞汇合度至90%时进行原代细胞冻存及恢复。并将其随机分为正常组和诱导组,正常组不予特殊处理,诱导组以含10 ng/mL IL-1β的10% FBS/DMEM进行干预。
2.2.2 IL-1β诱导大鼠关节软骨退变细胞
用0.25%的胰蛋白酶消化大鼠软骨细胞,用含5 ng/ml的IL-1β的细胞培养液传代培养一代,提前适应。将培养的大鼠原代软骨细胞消化后制备成细胞爬片。待细胞汇合度为40%-50%左右,换成含有5%FBS和10 ng/ml的IL-1β的细胞培养液,培养24 h后进行HE染色、免疫荧光检测细胞形态。
2.3 观察指标及方法
2.3.1 HE染色
加入2 ml的4%的多聚甲醛,室温固定。清洗后加入1 ml苏木精染色,清洗后加入1 ml伊红染色2 min,PBS及酒精清洗后,中性树脂封片观察。
3.1.2免疫荧光
加入2 ml的4%的多聚甲醛,室温固定。清洗后加入2 ml大鼠抗大鼠二抗,4℃过夜孵育。清洗三次加入山羊抗大鼠多克隆二抗,37℃避光孵育1 h,封片,荧光显微镜下观察。
2.3 软骨细胞增殖情况
将汇合度为80%-90%的IL-1β适应的软骨细胞消化,平均分成8份,离心、沉淀。分别用含IL-1β的培养液、益气养血方含药物血清(20%、10%、5%)的培养液、生理盐水含药血清(20%、10%、5%)的培养液和含阳性药物(30 ng/ml)的细胞培养液重悬,细胞计数后将细胞密度调整为2×105个/ml,接种至96孔细胞培养板中,每个做4个重复,以正常培养的细胞为空白对照,CCK8试剂盒测定24h和48h时各处理组细胞的A450,比较其生长状态。
2.4 Western blotting检测细胞β-catenin、WISP-1、MMP-1、MMP-13蛋白的表达
细胞分组,分组完成后收集细胞,加入适量裂解液,充分摇匀后置于冰浴裂解,离心后取上清获得细胞总蛋白。按照CBA法(碧云天生物技术公司)测定蛋白质浓度。8% SDS-PAGE凝胶电泳,200mA,1.5 h转膜,25 ml封闭缓冲液中封闭1 h,加入1 : 1000稀释的一抗,4 °C孵育过夜。TBST洗3次。加入1 : 2000稀释的HRP标记二抗室温孵育1 h, TBS/T清洗3次,ECL显色。
3 结果
3.1 HE染色
结果显示,正常的软骨细胞光滑、平整,呈多角形,贴壁后突起明显。均质状胞质呈红色, 较疏松。圆形或椭圆形胞核,体积较大,居中呈蓝色。IL-1β诱导后,软骨细胞表面欠光滑,细胞形态不规则。圆形或椭圆形胞核位于中央,居中呈蓝色。见图1。
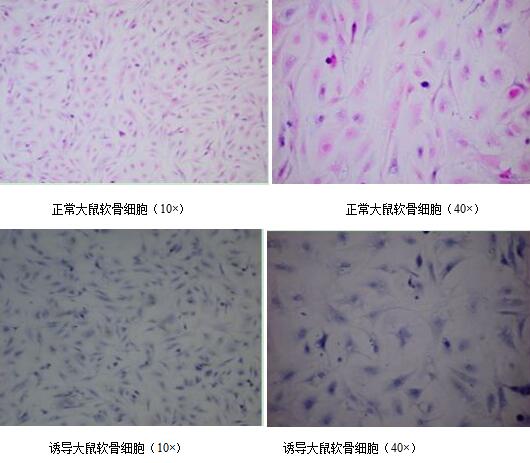
图1 大鼠软骨细胞HE染色
3.2 免疫荧光观察
结果显示,正常软骨细胞形态为不规则的多边形,细胞核染成蓝色,包浆呈现绿色,边缘整齐;IL-1β诱导的大鼠软骨细胞形态发生改变,边缘不整齐,少数细胞看到表面呈现碎裂感,区别于正常的大鼠软骨细胞,结果见图2。
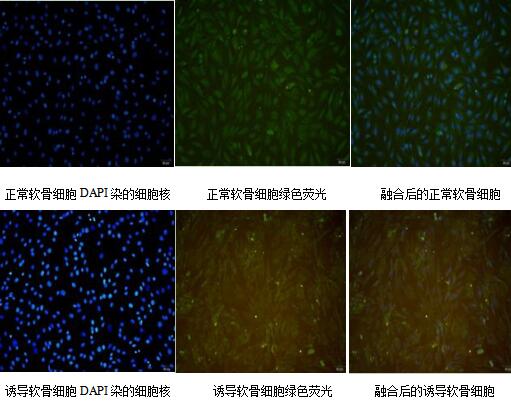
图2 大鼠软骨细胞免疫荧光图片(40×)
3.3 益气养血方血清对体外培养的大鼠膝关节软骨细胞增殖情况的影响
在24h,48h两个时间点,空白对照组(培养基对照)与模型对照组(IL-1β诱导组)比较,空白对照组OD A450值明显高于模型对照组(P<0.01),说明退行性软骨细胞诱导成功;各生理盐水血清组(5%、10%、20%)与模型对照组比较差异无统计学意义(P>0.05);与5%生理盐水血清组比较,10%、20%益气养血方血清组、阳性对照组(DKK-1组)高于5%生理盐水血清组(P﹤0.05,P﹤0.01);与阳性对照组比较,10%、20%益气养血方血清组差异无统计学意义(P>0.05)。实验结果显示,益气养血方血清对退变软骨细胞的增殖具有促进作用。见图13。

图13 益气养血方血清对体外培养的大鼠膝关节软骨细胞增殖情况的影响。用CCK8试剂盒测定24h和48h时各处理组细胞的A450,比较其生长状态。与模型对照组比较,**P<0.01;与5%生理盐水血清组比较,##P<0.01,#P<0.05。
3.4 Western blotting检测细胞β-catenin、WISP-1、MMP-1、MMP-13蛋白的表达
结果如图4所示,经过IL-1β诱导的大鼠软骨细胞中MMP-1、MMP-13、WISP-1和β-catenin蛋白表达量均上升,高于空白对照组,说明诱导大鼠退行性软骨细胞成功。检测发现,生理盐水血清各组中这四种蛋白表达量与诱导组一致,说明生理盐水血清对退行性软骨细胞没有治疗作用。药物血清组中,各蛋白表达量均有所下降。10%药物血清组,β-catenin、MMP-13、WISP-1和MMP-1的表达量与阳性药物组相似;20%药物血清组,四种蛋白的表达量均低于阳性药物组,说明20%的药物血清能明显抑制β-catenin、MMP-13、WISP-1和MMP-1的表达。

图4 益气养血方血清对大鼠软骨细胞β-catenin、WISP-1、MMP-1、MMP-13蛋白表达的影响。在药物干预后48h收集细胞,提取各组细胞总蛋白,Western blotting检测目的蛋白的表达情况。1、模型对照组(IL-1β诱导组);2、5%生理盐水血清组;3、10%生理盐水血清组;4、20%生理盐水血清组;5、空白对照组;6、5%益气养血方血清组;7、10%益气养血方血清组;8、20%益气养血方血清组;9、阳性对照组(DKK-1组)。
4 讨论
益气养血方是云南省名老中医吴生元教授总结出的治疗骨关节炎的有效良方。该方具有补益气血、调补肝肾、活络止痛之功。益气养血方的临床研究显示:益气养血方能明显改善患者症状及关节功能,临床安全性高,依从性好 [[[]李兆福,彭江云,肖长虹,等.骨痹(骨关节炎)诊疗方临床验证总结[J].风湿病与关节炎.2012,1(1):16-21.]]。实验研究表明,益气养血方能上调人膝骨关节炎软骨聚集蛋白聚糖mRNA,下调COL-10 mRNA表达;对大鼠WIF1水平有上调作用,下调大鼠Wnt4水平,具有明显的抗炎作用,能促进软骨细胞的体外增殖,保护软骨基质,抑制关节软骨病变[[[]李兆福,刘维超,狄朋桃,等.益气养血方对膝骨关节炎退变软骨组细胞蛋白聚糖和X型胶原mRNA表达的影响.中华中医药学会第十六届全国风湿病学术大会论文集,2012:44-48.]-10]。为此,在前期研究基础上,进一步在体外实验模型—IL-1β诱导大鼠软骨细胞退变模拟骨关节炎模型上,研究益气养血方对白介素诱导性大鼠关节炎的作用及部分机制。IL-1β诱导的关节软骨退变模型是研究骨关节炎的理想模型,也是世界上公认的关节炎模型[[[]Ding QH, Zhong HM, Qi YY, et al. Anti-arthritic effects of crocin in interleukin-1β treated articular chondrocytes and cartilage in a rabbit osteoarthritic model[J].Inflamm Res, 2013, 62(1): 17-25.]-12]。
Wnt/β-catenin信号通路是一条广泛存在且高度保守的信号通路,主要分为经典Wnt信号通路(Wnt/β-catenin信号通路)、PCP通路及Wnt/Ca2 +通路,涉及肿瘤、骨病、肝病、血管疾病、皮肤科疾病以及多种免疫类疾病[[[] Kanehisa M,et al.KEGG: kyoto encyclopedia of genes and genomes [J].Nucleic Acids Res,2000,Jan 01: 27-30.]-14]。Wnt信号通路参与软骨发育、稳态平衡及软骨的退化,干扰Wnt通路可以促进软骨再生[[[] Maruotti N ,Corrado A,Neve A,et al.Systemic effects of Wnt signaling [J].Journal of cellular physiology, 2013, 228(7):1428-1432.]-17]。其中研究最多的为Wnt/β-catenin信号通路,当Wnt/β-catenin信号被激活,细胞质内的β-catenin向核内转移,与转录因子结合后激活下游靶基因表达,上调的Wnt/β-catenin可促进关节软骨细胞的过度成熟、分化及凋亡,从而加重细胞外基质的降解、关节软骨退变及骨赘生成,在骨关节炎的发生及发展中起重要作用[[[] Staal FJ, Clevers H. Tcf/Lef transcription factors during T-cell development:unique and overlapping functions[J]. Hematol J. 2000;1:3–6.]-20]。
Wnt/β-catenin信号通路的表达,受上游抑制因子的调节,如sFPR3、WISP-1、DKK1等[[[] Loughlin J, Dowling B, Chapman K, Marcelline L, et al. Functional variants within the secreted frizzledrelated protein 3 gene are associated with hip osteoarthritis in females. Proc Natl Acad Sci U S A. 2004;101:9757–62.]-23],其中WISP-1在软骨发生退变时表达异常增高,促进下游的基质金属蛋白酶分泌使胶原蛋白与蛋白多糖的分解的表达导致关节软骨损伤,在滑膜内可使IL-6表达升高[[[] Blom AB, Brockbank SM, van Lent PL, et al. Involvement of the Wnt signaling pathway in experimental and human osteoarthritis: prominent role of Wnt-induced signaling protein 1. Arthritis Rheum. 2009;60(2):501–12.]]。在小鼠实验中,WISP-1在膝关节腺病毒中的高表达与关节软骨破坏程度成正相关[[[] VAN DEN BOSCH MH, BLOM AB, SLOETJES AW, et al. Induction of canonical Wnt signaling by synovial overexpression of selected Wnts leads to protease activity and early Osteoarthritis-Like cartilage damage[J]. Am J Pathol, 2015, 185(7):1970-1980.]]。当Wnt/β-catenin信号通路被激活后,下游靶基因如BMPs、MMPs、MYC被激活[[[] Liu F, Millar SE. Wnt/β-catenin signaling in oral tissue development and disease. [J]. J Dent Res, 2010, 89:381-330.]]。其中基质金属蛋白酶家族可与II 型胶原分子上的MMPs微电裂解位点结合使II 型胶原片段化,从而软骨细胞暴露于炎性环境中[[[] Hideto W. Aggrecan and its chondroitin sulfate in cartilage. Seikagaku. 2008;80(1):28-32]]。在关节软骨破坏严重的患者体内MMP-1、MMP-13呈高表达,可破坏关节软骨内稳态,加剧关节退变[[[] Wang M, Sampson ER, Jin HT, et al . MMP-13 is a critical target gene during the progression of osteoarthritis. Arthritis Res Ther, 2013, 15:R5.]-29]。
本研究结果表明,益气养血方对IL-1β诱导的关节软骨退变模型中软骨细胞凋亡有抑制作用,能下调β-catenin、WISP-1、MMP-1、MMP-13蛋白表达,减缓关节软骨退变。基于上述分析,推测益气养血方可能通过下调β-catenin、WISP-1,抑制相关Wnt/β-catenin信号通路激活,降低下游靶基因MMP-1、MMP-13的表达,可能是其保护关节软骨,减缓骨关节炎的病理发展的机制之一。
[参考文献]
[1] Neogi T.The epidemiology and impact of pain in osteoarthritis [J].Osteoarthritis Cartilage,2013,21( 9) : 1145-1153.
[2] Berenbaum.Osteoarthritis as an inflammatory disease [J].Osteoarthritis Cartilage,2013,21( 9) : 16-21.
[3]葛均波, 徐永健. 内科学[M].北京:人民卫生出版社,2013:852.
[4] GBD 2015 Disease and Injury Incidence and Prevalence Collaborators.Global, regional, and national incidence, prevalence, and years lived with disability for 310 diseases and injuries, 1990-2015: a systematic analysis for the Global Burden of Disease Study 2015 [J].The Lancet, vol. 388, no. 10053, pp. 1545–1602, 2016.
[5] K.E.Barbour,M.Boring,C.G.Helmick,L.B.Murphy,and Q. Jin.Prevalence of Severe Joint Pain Among Adults with Doctor-Diagnosed Arthritis—United States, 2002–2014 [J].Morbidity and Mortality Weekly Report, vol. 65, no. 39, pp. 1052–1056, 2016.
[6] Anwar Fathollahi, Saeed Aslani, Ahmadreza Jamshidi2. Epigeneticsinosteoarthritis:Novel spotlight[J]. Cell Physiol. 2019;1–16.
[7]李兆福,彭江云,肖长虹,等.骨痹(骨关节炎)诊疗方临床验证总结[J].风湿病与关节炎.2012,1(1):16-21.
[8]李兆福,刘维超,狄朋桃,等.益气养血方对膝骨关节炎退变软骨组细胞蛋白聚糖和X型胶原mRNA表达的影响.中华中医药学会第十六届全国风湿病学术大会论文集,2012:44-48.
[9]李兆福,万春平,赵杯沛,等.益气养血方对兔膝OA模型软骨细胞凋亡及炎症因子表达的影响[A].全国第十届中西医结合风湿病学术会议论文汇编[C].2012,20-64.
[10]李翠葳,郑喜,李兆福,等.益气养血方对膝骨关节炎模型大鼠血清Wnt4和WIF1的影响[J].风湿病与关节炎.2017,6(6):5-10.
[11]Ding QH, Zhong HM, Qi YY, et al. Anti-arthritic effects of crocin in interleukin-1β treated articular chondrocytes and cartilage in a rabbit osteoarthritic model[J].Inflamm Res, 2013, 62(1): 17-25.
[12]闫虎,苏友新,林学.IL-1β诱导新西兰大白兔膝关节退变软骨细胞的体外培养及鉴定[J]. 中国中西医结合杂志,2014,1(34):81-86.
[13] Kanehisa M,et al.KEGG: kyoto encyclopedia of genes and genomes [J].Nucleic Acids Res,2000,Jan 01: 27-30.
[14]周学溢,张超,孟智宏. Wnt信号通路在中医药领域的研究进展[J].辽宁中医药杂志,2014,41(10):2260-2263.
[15] Maruotti N ,Corrado A,Neve A,et al.Systemic effects of Wnt signaling [J].Journal of cellular physiology, 2013, 228(7):1428-1432.
[16] Ma B,Landman E B M,Miclea R L,et al.WNT signaling and Cartilage:Of Mice and Men [J]. Calcified tissue international, 2013, 93(5):399-411.
[17] Chen Y,Alman B A.Wnt pathway,an essential role in bone regenation [J]. Journal of cellular physiology, 2009, 106(3):353-362.
[18] Staal FJ, Clevers H. Tcf/Lef transcription factors during T-cell development:unique and overlapping functions[J]. Hematol J. 2000;1:3–6.
[19] Inhibition of Wnt/β-catenin signaling ameliorates osteoarthritis in a murine model of experienmental osteoarthritis[J].JCI Insight,2018,2(08):226-235.
[20] Yuasa T, Otani T, Koike T, et al.Wnt/β-catenin signaling stimulates matrix catabolic genes and activity in articular chondrocytes: its possible role in joint degeneration[J].Lab Invest,2008,88:264-274.
[21] Loughlin J, Dowling B, Chapman K, Marcelline L, et al. Functional variants within the secreted frizzledrelated protein 3 gene are associated with hip osteoarthritis in females. Proc Natl Acad Sci U S A. 2004;101:9757–62.
[22] Min JL, Meulenbelt I, Riyazi N, et al. Association of the frizzled related protein gene with symptomatic osteoarthritis at multiplesites. Arthritis Rheum. 2005;52:1077–80.
[23] Honsawek S, Tanavalee A, Yuktanandana P, et al. Dickkopf-1 (Dkk-1) in plasma and synovial fluid is inversely correlated with radiographic severity of knee osteoarthritis patients. BMC Musculoskelet Disord. 2010;11:257.
[24] Blom AB, Brockbank SM, van Lent PL, et al. Involvement of the Wnt signaling pathway in experimental and human osteoarthritis: prominent role of Wnt-induced signaling protein 1. Arthritis Rheum. 2009;60(2):501–12.
[25] VAN DEN BOSCH MH, BLOM AB, SLOETJES AW, et al. Induction of canonical Wnt signaling by synovial overexpression of selected Wnts leads to protease activity and early Osteoarthritis-Like cartilage damage[J]. Am J Pathol, 2015, 185(7):1970-1980.
[26] Liu F, Millar SE. Wnt/β-catenin signaling in oral tissue development and disease. [J]. J Dent Res, 2010, 89:381-330.
[27] Hideto W. Aggrecan and its chondroitin sulfate in cartilage. Seikagaku. 2008;80(1):28-32
[28] Wang M, Sampson ER, Jin HT, et al . MMP-13 is a critical target gene during the progression of osteoarthritis. Arthritis Res Ther, 2013, 15:R5.
[29] Hamamura K, Lin CC, Yokota H, et al . Salubrinal reduces expression and activity of MMP13 in chondrocytes. Osteoarthr Cartilage , 2013,21: 764 ~ 772.
- 刘尚义 | 兰茂论坛多而雅,承先启后更风流
- 2019/11/21 国医在线
- 温伟波 | 打造特色中医药文化阵地,做百姓信赖的医院
- 2019/11/21 国医在线
- 和丽生 | 发展“定制药园”产业,打造“云药”名片,助力扶贫攻坚
- 2019/11/21 国医在线
- 张勋 | 做好文化宣传,促进中医药文化的发展
- 2019/11/21 国医在线






